Invecchiamento biologico: le tappe critiche e le strategie per invecchiare bene
L'invecchiamento non è un declino graduale, ma accelera in due "ondate" critiche a 44 e 60 anni. Questo articolo analizza i meccanismi biologici alla base della senescenza e presenta le strategie scientifiche più efficaci, dalla nutrizione alla gestione dello stress, per estendere non solo la vita, ma gli anni vissuti in piena salute (Healthspan)
12/7/20258 min read
Sommario
La scienza della longevità
I 12 Hallmarks dell'invecchiamento: la mappa del declino cellulare
I motori primari del danno
Le risposte antagonistiche
I colpevoli sistemici (Integrativi)
La cronologia dell'invecchiamento non è una discesa lineare
Lifespan vs. Healthspan: il paradosso italiano
Strategie di intervento
Il futuro: senolitici e orologi biologici
La scienza della longevità
L'invecchiamento umano è stato a lungo considerato un processo lineare, inesorabile e governato esclusivamente dal ticchettio dell'orologio cronologico. Tuttavia, la geroscienza moderna (il campo che studia la biologia dell'invecchiamento) ha radicalmente riscritto questa narrazione. Oggi sappiamo che l'età anagrafica è solo un indicatore approssimativo dello stato di deterioramento cellulare; il vero protagonista è l'invecchiamento biologico, un processo malleabile, scandito da accelerazioni improvvise e influenzato in modo determinante dallo stile di vita.
Questo report analizza lo stato dell'arte della ricerca sulla longevità, integrando le più recenti scoperte sui meccanismi molecolari (i "Hallmarks"), le nuove evidenze sulle "ondate" di invecchiamento a 44 e 60 anni, e le strategie validate per comprimere la morbilità. L'obiettivo non è la mera estensione della vita (lifespan), ma l'ottimizzazione della durata della salute (healthspan), riducendo il divario tra gli anni vissuti e gli anni vissuti in piena funzionalità fisica e cognitiva.
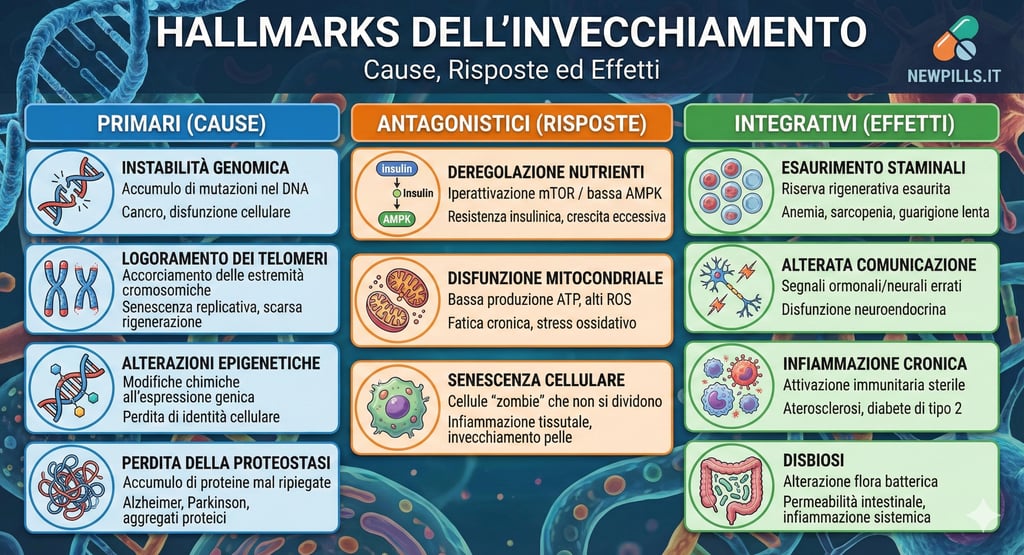
I 12 Hallmarks dell'invecchiamento: la mappa del declino cellulare
Per decenni, la biologia ha cercato di identificare le cause radice dell'invecchiamento. La svolta è arrivata con la codificazione dei "Hallmarks of Aging" (segni distintivi dell'invecchiamento), un quadro concettuale che definisce i processi biochimici che guidano il deterioramento. Originariamente nove, una revisione fondamentale pubblicata su riviste come Cell e Nature Aging nel 2023 ha espanso questo elenco a dodici segni interconnessi, offrendo una visione sistemica della senescenza.
Questi dodici processi non agiscono isolatamente, ma seguono una gerarchia causale che si muove dai danni molecolari primari verso risposte cellulari disfunzionali, culminando nel fallimento funzionale dei tessuti.
I motori primari del danno
Alla base della piramide dell'invecchiamento troviamo i danni molecolari che si accumulano nel tempo. L'instabilità genomica rappresenta il primo colpo: il DNA accumula mutazioni dovute a fattori esogeni e difetti di replicazione, minando l'integrità del codice genetico. Parallelamente, assistiamo al logoramento dei telomeri, le strutture protettive alle estremità dei cromosomi che si accorciano a ogni divisione cellulare, funzionando come un orologio biologico che limita la capacità rigenerativa dei tessuti. A complicare il quadro intervengono le alterazioni epigenetiche, modifiche chimiche al DNA che non cambiano la sequenza genica ma ne alterano l'espressione, facendo sì che le cellule "dimentichino" la loro funzione specifica. Infine, la perdita della proteostasi (l'incapacità di ripiegare o eliminare correttamente le proteine) e la disabilitazione della macroautofagia (il blocco del sistema di riciclaggio cellulare) portano all'accumulo di rifiuti tossici intracellulari, un fattore chiave nelle malattie neurodegenerative.
Le risposte antagonistiche
In risposta a questi danni primari, il corpo attiva meccanismi di difesa che, se cronicizzati, diventano paradossalmente dannosi. La deregolazione del rilevamento dei nutrienti è cruciale: vie metaboliche come mTOR (che segnala crescita) e AMPK (che segnala scarsità) perdono la loro calibrazione, promuovendo l'invecchiamento quando i nutrienti sono eccessivi. La disfunzione mitocondriale vede le centrali energetiche della cellula perdere efficienza e produrre più radicali liberi. Emerge qui la senescenza cellulare: le cellule danneggiate smettono di dividersi per prevenire tumori, trasformandosi in "cellule zombie" che secernono molecole infiammatorie (SASP), danneggiando il tessuto circostante.
I colpevoli sistemici (Integrativi)
Il risultato finale di questa cascata è il declino funzionale dell'organismo. L'esaurimento delle cellule staminali impedisce la riparazione dei tessuti. L'alterata comunicazione intercellulare e l'infiammazione cronica ("inflammaging") creano un ambiente sistemico tossico che favorisce malattie cardiovascolari e metaboliche. Infine, la disbiosi intestinale altera l'equilibrio del microbioma, influenzando negativamente l'immunità e la salute cerebrale.
Dati estratti da Lopez-Otin et al., Cell 2023.
La cronologia dell'invecchiamento non è una discesa lineare
Una delle scoperte più dirompenti del 2024, proveniente dai laboratori della Stanford University, ha sfatato il mito dell'invecchiamento graduale. Analizzando il profilo molecolare di migliaia di campioni biologici, i ricercatori hanno identificato che l'invecchiamento umano procede per "ondate" o esplosioni (bursts), con due picchi drammatici di cambiamento molecolare.
Il preludio: i 30 anni
Sebbene i cambiamenti visibili siano minimi, il declino fisiologico inizia molto prima della mezza età. Già intorno ai 30 anni, organi vitali come reni, fegato e cuore raggiungono il picco funzionale e iniziano una lenta discesa. È in questa decade che inizia la sarcopenia (perdita di massa muscolare) se non contrastata, e i telomeri cominciano ad accorciarsi a ogni divisione cellulare.
La prima ondata: 44 Anni
Intorno ai 44 anni, il corpo umano subisce una massiccia riorganizzazione molecolare. Contrariamente a quanto si pensava, questo non è un fenomeno limitato alle donne in perimenopausa; cambiamenti simili sono stati osservati anche negli uomini, suggerendo una radice biologica indipendente dagli ormoni sessuali.
In questa fase si verificano alterazioni significative nel metabolismo dei lipidi, dell'alcol e della caffeina. Le molecole associate alle malattie cardiovascolari subiscono un'impennata, così come quelle legate all'invecchiamento della pelle e dei muscoli. Questo spiega l'improvviso aumento del colesterolo, la difficoltà a metabolizzare cibi e bevande un tempo tollerati e la comparsa accelerata di rughe.
La seconda ondata: 60 Anni
Il secondo grande punto di svolta avviene all'inizio dei 60 anni. In questa fase, i cambiamenti riguardano prevalentemente la regolazione del sistema immunitario e il metabolismo dei carboidrati. Il declino della funzione immunitaria rende l'organismo più suscettibile a infezioni e tumori, mentre l'alterata gestione degli zuccheri aumenta il rischio di diabete di tipo 2. Anche la funzione renale mostra un deterioramento accelerato in questa finestra temporale.
Lifespan vs. Healthspan: il paradosso italiano
L'obiettivo della medicina moderna è spostato dall'aumentare semplicemente il numero di candeline sulla torta (Lifespan) all'aumentare gli anni vissuti in assenza di malattie croniche e disabilità (Healthspan).
I dati Eurostat rivelano una realtà agrodolce per l'Italia. Sebbene il nostro Paese vanti una delle aspettative di vita più alte d'Europa (seconda solo a Spagna e Francia in alcune metriche), la qualità di questi anni aggiuntivi è spesso compromessa.
I dati indicano un divario significativo: mentre un uomo italiano può aspettarsi di vivere oltre 80 anni, gli anni vissuti in "buona salute" (senza limitazioni funzionali) si fermano mediamente a 67-68 anni. Questo lascia una finestra di circa 12-15 anni di vita in condizioni di salute subottimale, caratterizzata da gestione di patologie croniche. Colmare questo divario è la missione della geroscienza.
Dati basati su statistiche Eurostat 2022-2023.
Strategie di intervento
La genetica influisce sulla longevità solo per il 20-30%; il restante 70-80% dipende da fattori ambientali e comportamentali modificabili. Ecco le strategie più efficaci emerse dalla letteratura scientifica per rallentare i hallmarks dell'invecchiamento.
1. Nutrizione: tempismo, quantità e molecole
L'alimentazione agisce direttamente sul rilevamento dei nutrienti (mTOR/Insulina) e sull'infiammazione.
Restrizione Calorica e Digiuno Intermittente:
La restrizione calorica (CR) è l'intervento più robusto per estendere la vita nei modelli animali. Tuttavia, studi recenti su topi geneticamente diversi hanno mostrato che mentre la CR estende la vita, una perdita di peso eccessiva può ridurre la resilienza. Il Digiuno Intermittente (IF), come il Time-Restricted Eating, offre benefici metabolici simili alla CR (migliore sensibilità all'insulina, attivazione dell'autofagia) con una maggiore aderenza negli esseri umani. La chiave è evitare la malnutrizione pur mantenendo periodi di riposo metabolico che permettono alle cellule di "pulirsi" (autofagia).
Il paradosso delle proteine:
Con l'avanzare dell'età, si sviluppa una "resistenza anabolica", rendendo i muscoli meno reattivi agli stimoli proteici. Per prevenire la sarcopenia (perdita muscolare), gli over 65 necessitano di più proteine rispetto ai giovani, non meno. Il consenso internazionale raccomanda 1.0–1.2 g/kg di peso corporeo al giorno per anziani sani, salendo a 1.2–1.5 g/kg per chi soffre di malattie croniche o sarcopenia. È fondamentale consumare almeno 25-30g di proteine per singolo pasto per attivare la sintesi muscolare.
Polifenoli e attivatori delle sirtuine:
Composti come il resveratrolo (vino rosso, uva), la quercetina (mele, capperi), la fisetina (fragole) e le catechine (tè verde) agiscono come mimetici della restrizione calorica. Essi attivano le sirtuine (in particolare SIRT1), enzimi che riparano il DNA e migliorano la stabilità genomica. Una dieta ricca di questi alimenti, tipica delle "Zone Blu", supporta la resilienza cellulare.
2. Attività fisica: oltre il semplice movimento
L'esercizio fisico è l'unico intervento noto per agire positivamente su quasi tutti i 12 hallmarks.
Telomeri e Infiammazione: Una meta-analisi ha confermato che l'attività fisica è associata a telomeri più lunghi. L'allenamento ad alta intensità (HIIT) e di resistenza sembra avere effetti superiori rispetto all'attività moderata continua nel promuovere adattamenti cellulari rapidi.
Muscolo come Organo Endocrino: L'allenamento di forza non serve solo all'estetica; il muscolo scheletrico rilascia miochine, molecole antinfiammatorie che comunicano con cervello, tessuto adiposo e ossa, contrastando l'infiammazione sistemica. Considerata l'accelerazione della perdita muscolare dopo i 40 anni, l'allenamento con i pesi diventa un imperativo biologico, non un optional.
3. Sonno e sistema glifatico: la pulizia notturna
Durante il sonno, il cervello attiva il sistema glifatico, una rete di drenaggio che utilizza il liquido cerebrospinale per eliminare le scorie metaboliche accumulate durante la veglia, inclusa la beta-amiloide (precursore dell'Alzheimer).
Posizione del Sonno: Studi preclinici suggeriscono che la posizione laterale (dormire sul fianco) massimizza l'efficienza del flusso glifatico rispetto alle posizioni supina o prona, facilitando la rimozione dei rifiuti neurotossici.
Frammentazione: La frammentazione del sonno, comune nell'anziano, interrompe questo processo di pulizia, accelerando la neurodegenerazione. Prioritizzare l'igiene del sonno è una strategia preventiva diretta contro le demenze.
4. Riserva cognitiva: bilinguismo e complessità
Per proteggere il cervello dall'invecchiamento, la "riserva cognitiva" è fondamentale. Essa permette al cervello di tollerare meglio i danni patologici.
Il potere del bilinguismo: parlare due lingue costringe il cervello a un esercizio costante di inibizione e commutazione (controllo esecutivo). Meta-analisi hanno dimostrato che nei soggetti bilingui, l'insorgenza dei sintomi della demenza di Alzheimer è ritardata mediamente di 4-5 anni rispetto ai monolingui, un risultato superiore a qualsiasi terapia farmacologica attuale.
Cruciverba vs. brain training: non tutte le attività sono uguali. Mentre i generici "giochi per il cervello" spesso non mostrano benefici trasferibili alla vita reale, studi specifici (come il Bronx Aging Study) hanno rilevato che attività come i cruciverba possono ritardare il declino della memoria di circa 2,5 anni, probabilmente grazie all'attivazione verbale e mnemonica specifica. Tuttavia, l'impegno sociale e l'apprendimento di nuove abilità complesse (es. uno strumento musicale) sono superiori ai compiti passivi.
BDNF: L'esercizio fisico e la stimolazione cognitiva aumentano i livelli di BDNF (Brain-Derived Neurotrophic Factor), una proteina cruciale per la neuroplasticità e la sopravvivenza dei neuroni nell'ippocampo, area critica per la memoria.
5. Ormesi: sauna e shock termico
L'esposizione a stress termici controllati (ormesi) potenzia i meccanismi di riparazione. Uno studio fondamentale su oltre 2.300 uomini finlandesi ha mostrato che l'uso frequente della sauna (4-7 volte a settimana) è associato a una riduzione del 40% della mortalità per tutte le cause e del 63% della morte cardiaca improvvisa. Il calore attiva le Heat Shock Proteins (HSP), che prevengono l'aggregazione proteica e migliorano la salute vascolare, imitando gli effetti cardiovascolari dell'esercizio fisico moderato.
6. Gestione dello stress e telomeri
Lo stress cronico non è solo una sensazione mentale; è un acceleratore biologico dell'invecchiamento. Alti livelli di cortisolo inibiscono la telomerasi, l'enzima che ripara i telomeri. Studi hanno quantificato che le donne con alti livelli di stress percepito hanno telomeri più corti, equivalenti a un invecchiamento biologico aggiuntivo di circa 10 anni rispetto a donne con bassi livelli di stress. Anche la reattività al cortisolo è predittiva: chi ha picchi di cortisolo più alti in risposta allo stress mostra un logoramento dei telomeri più rapido.
Il futuro: senolitici e orologi biologici
La frontiera della geroscienza si sta muovendo verso interventi farmacologici diretti. I senolitici sono una nuova classe di farmaci (come la combinazione Dasatinib + Quercetina o la Fisetina) progettati per eliminare selettivamente le cellule senescenti ("zombie"). Trial clinici preliminari stanno valutando la loro sicurezza ed efficacia nel trattare patologie legate all'età come la fragilità e l'Alzheimer, con risultati attesi tra il 2024 e il 2025.
Parallelamente, la disponibilità di orologi biologici (test epigenetici o proteomici che misurano l'età biologica reale su campioni di sangue) sta iniziando a diffondersi anche in Italia (es. studi a Bologna e cliniche specializzate), permettendo per la prima volta di misurare oggettivamente se il nostro stile di vita sta accelerando o rallentando il nostro invecchiamento.
L'invecchiamento non è un destino passivo, ma un processo dinamico su cui abbiamo un significativo potere di intervento. Le evidenze scientifiche suggeriscono un approccio multimodale: nutrire il corpo per la riparazione (proteine e polifenoli), sfidarlo fisicamente (resistenza e aerobica), pulirlo metabolicamente (sonno e digiuno intermittente) e proteggerlo dallo stress cronico. Riconoscere le tappe critiche dei 40 e 60 anni permette di agire preventivamente, trasformando la longevità da una semplice questione di anni vissuti a una questione di vitalità mantenuta.